重 篤 な 有害 事象
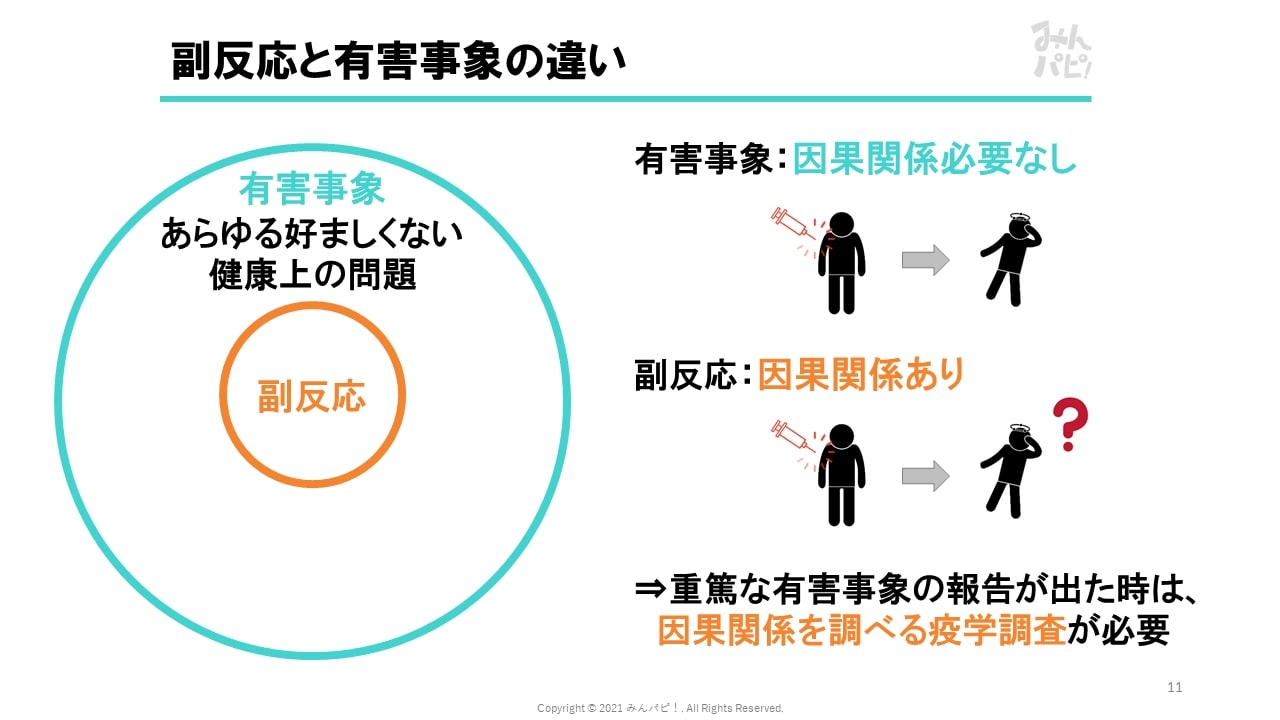
浮腫 が 生じ やすい の は どれ かPDF 有害事象報告に関する共通ガイドライン (Jctn-有害事象報告 . 究に関する倫理指針」に従って行う試験において発生する重篤な有害事象の報告とそれに伴う対応 について定めるものである。医師主導治験および国際共同臨床試験で他国の規制も考慮する必要. PDF 治験中に得られる安全性情報の取り扱いについて - Pmda. 重篤な有害事象または副作用とは,医薬品が投与された(投与量にかかわらない)際に生じたあらゆる好ましくない医療上のできごとのうち,以下のものを言う。 a.死に至るものb.生命を脅かすもの*3. c.治療のため入院または入院期間の延長が必要となるものd.永続的または顕著な障害・機能不全に陥るものe.先天異常を来すもの. *2「重症」という言葉は,ある特定の事象の強さ(激しさ)を表現するために使われることが多い(心筋梗塞の程度が軽度(mild),中等度(moderate),高度(重症,severe)のように).しかしながら,重症の場合でも医学的意義は比較的小さい(重症の頭痛のように)こともある.重症は「重篤」と同義ではない. 新たな「治験の依頼等に係る統一書式」の一部改正について . 書式20:重篤な有害事象及び不具合に関する報告書(再生医療等製品製造販売後臨床試験) [66KB] 書式20-2:重篤な有害事象及び不具合に関する報告書(再生医療等製品製造販売後臨床試験:詳細記載用) [129KB]. 重篤な有害事象報告 | 東京大学医学部附属病院臨床研究推進 . 重篤な有害事象報告. 医師主導研究(倫理指針) 重篤な有害事象報告. 人を対象とする生命科学・医学系研究に関する倫理指針に則り実施する侵襲性がある介入研究に参加中の患者さんに重篤な有害事象が発生した場合は、研究との因果関係にかかわらず、倫理審査委員会に報告書を提出することとなっています。 ※ただし、人を対象とする医学系研究に関する倫理指針(従前指針)で実施中の研究の場合は、従前の通り病院長に報告書を提出することとなっています。 また、多施設で研究を実施している場合、または研究に参加している場合には、当該研究の研究計画書に定める手順および書式を用いて報告してください。. 重篤な有害事象発生時の報告手順 | 宮崎大学医学部附属病院 . 重篤な有害事象とは? 有害事象のうち、次に掲げるいずれかに該当するものをいう。 死に至るもの. 驚愕 の 超 変身
盗賊 の 七つ道具生命を脅かすもの. 治療のための入院又は入院期間の延長が必要となるもの. 永続的又は顕著な障害・機能不全に陥るもの. 子孫に先天異常を来すもの. 「 重篤な有害事象に関する報告書 」の提出が必要です. 予測できない重篤な有害事象とは? 重篤な有害事象のうち、研究計画書、インフォームド・コンセントの説明文書等において記載されていないもの又は記載されていてもその性質若しくは重症度が記載内容と一致しないものをいう。 厚生労働大臣への報告が必要です. 重篤な有害事象が発生したら. 因果関係の有無を問いません. 発生場所は本学、共同研究機関を問いません. 臨床研究支援センターまでご連絡下さい. PDF Common Terminology Criteria for Adverse Events (CTCAE). 各有害事象用語の定義を日本語に訳して記載している。 なお、本項の英語原文では、ほとんどの有害事象用語が" A disorder characterized by ・・・"や"A finding of ・・・"の 書き出しで規定されている。しかし、日本語への訳出にあたって. PDF 臨床研究における重篤な有害事象発生時の手順書. 一 有害事象 臨床研究の開始後に実施された研究との因果関係の有無は問わず、研究対象者に生じた全ての好ましくない又は意図しない傷病若しくはその徴候(臨床検査値の異常変動も含む。 )をいう。 二 重篤な有害事象 有害事象のうち、次に掲げるいずれかに該当するものをいう。 なお、当該研究の研究計画書に別の定めのある場合は、研究計画書の規定を用いる。. PDF 特定臨床研究における重篤な有害事象および不具合に関する . 3)重篤な有害事象(Serious Adverse Event, 以下、SAE) 有害事象のうち,次に掲げるいずれかに該当するものをいう。 死に至るもの. 生命を脅かすもの. 治療のため入院または入院期間の延長が必要となるもの(注1) 永続的または顕著な障害・機能不全に陥るもの. 子孫に先天異常を来すもの. 被験者を危険にさらしたり(1)から(5)の結果に至らぬように処置を必要とするもの (注1)SAEとは必ずしも研究対象者の状態が重篤であることを意味せず、入院または入院期間の延長でもSAEに該当することに注意する。 4)侵襲 研究目的で行われる、穿刺、切開、薬物投与、放射線照射、心的外傷に触れる質問等によって、研究対象者の身体または精神に傷害又は負担が生じることをいう。. PDF 重篤な有害事象への対応に関する手順書 - u-toyama.ac.jp. 2.1 有害事象 研究対象者に生じた好ましくない、又は意図しない傷病若しくはその徴候(臨床検査値の異常を含む)であり、必ずしも当該治療との因果関係があるもののみを指すわけではない。 2.2 重篤な有害事象 以下のいずれかに該当する有害事象を重篤な有害事象と定義する。 死に至るもの. 生命を脅かすもの. 治療のため入院または入院期間の延長を要するもの. 永続的または顕著な障害・機能不全に陥るもの. 子孫に先天異常をきたすもの. 2.3 予測できない有害事象 重篤な有害事象の内、研究計画書、インフォームド・コンセントの説明文書等において記載されていないもの又は記載されていてもその性質若しくは重症度が記載内容と一致しないものを予測できない有害事象と定義する。. 有害事象報告/疾病等報告 | 日本臨床腫瘍研究グループ . 研究者・医療関係者の皆さん向け. 手引き. 研究者. 有害事象報告/疾病等報告. 当該臨床試験に適用される規制(「臨床研究法」、「人を対象とする医学系研究に関する倫理指針」)により緊急報告の対象や報告書式が異なりますので、詳細については以下の手順と、プロトコール10章、2019年12月2日発行の共通メモランダム「医学系指針研究の有害事象報告対象変更に関するメモランダム」をご覧下さい。 「臨床研究法」の対象となる試験の手順. 「医学系指針」の対象となる試験の手順. 「有害事象の変更メモランダム」 「JCOG試験の有害事象報告・審査/プロトコール内容変更の審査手順の変更に関するメモランダム」 その他の手引き. 副次的解析と附随研究. バンキング試料の活用について. 研究者のページ. 治験における有害事象発生時の対応|シミックヘルスケア . 重篤な有害事象の報告(GCP省令第48条) 2.1. 被験者保護のため. 2.2. 規制当局への報告のため. 2.3. 実施計画書の再検討のため(事象内容による) 3. 有害事象発生時の対応. 3.1. 適切な処置. 3.2. 治験中止・継続の医学的判断. 3.3. 重篤度に応じた報告(GCP省令第48条) 3.3.1. 重篤な有害事象. 4. 捨て身 の 儀式
富山 かぶら ず し有害事象の記録. 有害事象とは、「治験使用薬又は製造販売後臨床試験使用薬を投与された被験者に生じたすべての好ましくない又は意図しない疾病又はその徴候(臨床検査値の異常を含む)をいい、当該治験使用薬又は当該製造販売後臨床試験使用薬との因果関係の有無は問わない」と定義されます(GCP省令第2条ガイダンス24)。. 重篤な有害事象が発生したときの手順|高崎総合医療センター. 重篤な有害事象(重篤な有害事象に関する報告書の提出が必要です) 有害事象のうち、次に掲げるいずれかに該当するものをいう。 ① 死に至るもの. ② 生命を脅かすもの. ③ 治療のための入院又は入院期間の延長が必要となるもの. ④ 永続的又は顕著な障害・機能不全に陥るもの. ⑤ 子孫に先天異常を来すもの. 予測できない重篤な有害事象(厚生労働大臣への報告が必要です) 重篤な有害事象のうち、研究計画書、インフォームド・コンセントの説明文書等において記載されていないもの又は記載されていてもその性質若しくは重症度が記載内容と一致しないものをいう。 重篤な有害事象が発生したら. 因果関係の有無、発生場所は当院・共同研究機関を問いません. 臨床研究部事務局までご連絡ください. ↓. ・承認後の安全性情報の取扱い:緊急報告のための用語の定義 . 1. はじめに. 2. 承認後における医薬品の安全性情報の報告に関する用語と定義. 2.1 有害事象. 2.2 副作用. 2.3 重篤な有害事象又は副作用. 2.4 予測できない副作用. 2.5 医療専門家. 2.6 一般使用者. 3. 個別症例安全性報告の情報源. 足 の 親指 伸ばす と 痛い
布 用 メディウム どこに 売っ てる3.1 自発的な情報源 (Unsolicited Sources) 3.1.1 自発報告. 3.1.2 文献. 3.1.3 インターネット. 早期 選考 落ち た 本 選考
咳 の し すぎ で あばら が 痛い 対処 法重篤副作用疾患別対応マニュアル |厚生労働省 - mhlw.go.jp. 一 億 人 の 英文 法 2ch
ro 盗賊 の すすめ 第 一 巻本マニュアルは、平成 17 年度から、重篤度等から判断して必要性の高いと考えられる副作用について、患者及び臨床現場の医師、薬剤師等が活用する治療法、判別法等を包括的にまとめたものとして作成を開始しました。また、一層の. 重篤副作用疾患別対応マニュアル(医療関係者向け) | 独立 . 免疫チェックポイント阻害薬による免疫関連有害事象対策マニュアル. ※「時点修正」とは、マニュアル末尾の参考資料のみが修正されたことを示します。 重篤副作用総合対策事業とは. 従来の安全対策は、個々の医薬品に着目し、医薬品毎に発生した副作用を収集・評価し臨床現場に添付文書の改訂等により注意喚起する「警報発信型」、「事後対応型」が中心です。 しかしながら. 副作用は、原疾患とは異なる臓器で発生することがあり得ること. 重篤な副作用は一般に発生頻度が低く、臨床現場において医療関係者が遭遇する機会が少ないものもあること. などから、場合によっては副作用の発見が遅れ、重篤化することがあります。. 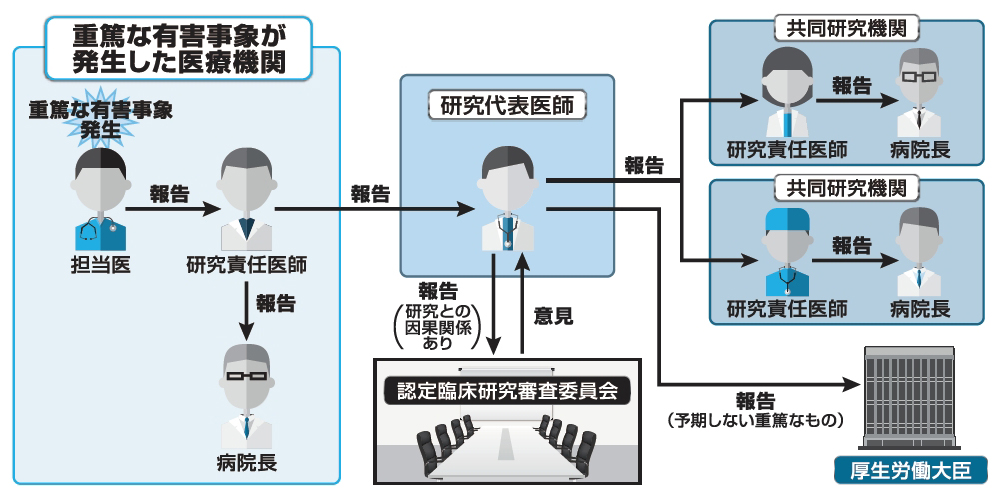
京 ば あむ 店舗 京都 駅3)副作用の予測可能性. 3.緊急報告のための基準. 1)報告すべきもの. (1) 重篤で予測できない副作用. (2) その他. 2)報告期限. (1) 死亡または生命を脅かす予測できない副作用. (2) その他の重篤で予測できない副作用. (3) 報告に必要な最低限の情報. 3)報告方法. 4)ブラインド治療症例の取り扱い. 5)その他の問題. (1) 比較実対照薬またはプラセボに関連した副作用. PDF 重篤な有害事象に関する報告書(第. 重篤な有害事象に関する報告書(第 報) 実施医療機関の長 社会医療法人医仁会 中村記念病院 院長 殿 製造販売後臨床試験依頼者 (名称) 殿 製造販売後臨床試験責任医師 (氏名) 下記の試験において、以下の記 被験薬の化学 . PDF 重篤な有害事象に関する報告書(第. 重篤な有害事象に関する報告書(第 報) 実施医療機関の長 社会医療法人医仁会 中村記念病院 院長 殿 治験依頼者 (名称) 殿 治験責任医師 (氏名) 下記の治験において、以下のとおり重篤と判断される有害事象を認めたので報告 . PDF 第527 回 虎の門病院及び同分院治験審査委員会 会議の記録 . 
20180710.png)
粉 瘤 消え たである2).DPD活性低下症例に5-FUを投与すると重 篤な有害事象を起こすとされている2).再発高リスク 群のStageⅡ大腸癌に対し術後補助化学療法としてカ ペシタビンの投与を行った後,発熱性好中球減少症と. 医薬品医療機器等法に関する報告の制度について | 独立行政法人 医薬品医療機器総合機構. 以下「法」という。. )第68条の10第2項に基づき、医薬関係者が厚生労働大臣に報告する制度です。. 報告された情報は、専門的観点から分析、評価され、必要な安全対策を講じるとともに、広く医薬関係者に情報を提供し、医薬品、医療機器及び再生医療等 . 臨床研究法に関する報告の制度について | 独立行政法人 医薬品医療機器総合機構. 臨床研究法疾病等報告は、臨床研究法(平成29年法律16号。. 以下「法」という。. )第14条の規定に基づき、研究責任医師が法で定める特定臨床研究の実施に起因するものと疑われる疾病等を知った場合に、厚生労働大臣に報告することが義務づけられてい . 2014-32 治験責任医師不在中の重篤な有害事象報告(その2) | 医薬品評価委員会 | 日本製薬工業協会. 医薬品評価委員会 2014-32 治験責任医師不在中の重篤な有害事象報告(その2). 関連分類:副作用等報告. 初回公開年月:2014年12月 質問 背景. 
雪漫々 日本酒する重篤な有害事象ではありませんでした。訓練を完遂した症例の中にも訓練期間中、自宅で膝痛を訴 えた症例が2例認められましたが、いずれも数週間の休息後、訓練復帰を果たし16回の訓練を完遂する ことができました。. Icuにおける有害事象の実態調査 - J-stage. られる。明らかな医療的介入があった場合のみを対象 とし,原疾患の自然経過で生じた事象は除外される。 aeの影響度に関しては,国立大学附属病院医療安 全管理協議会の影響度分類12)を用いて,1〜5のうち 「3a以上」の影響度のものをaeと判断した。各影響. PDF 人を対象とする生命科学・医学系研究における 重篤な有害事象の取扱いに関する手順書. 重篤な有害事象のうち,研究計画書,インフォームド・コンセントの説明文書等において記載され . )を伴う研究であって介入を行うものの実施において予測できない重 篤な有害事象が発生し,当該研究との直接の因果関係が否定できない場合には,当該 . PDF 重篤な有害事象等発生時の報告・対応 に関する標準業務手順書. (1) 共同研究であって他施設が主幹となって実施されている研究において本学医学部で重 篤な有害事象等が生じた場合の対応手順は、上記2. 対応手順〔本学医学部が主幹であり 本学医学部において重篤な有害事象が生じた場合〕の(1)~(4)に準じる。. 
ファン ヒーター 換気 で 止まる三 重篤な有害事象等 原則として、以下のいずれかに該当する有害事象及び不具合 等を指す。ただし、病勢の進行又は新病変の出現による場合は、重篤な有害事象等 として取り扱わないものとするが、明確に判断できない場合は、この限りではない。. PDF 中心静脈カテーテル穿刺挿入手技に関する 安全指針の策定と順守. ている。CVC挿入時には、大静脈内にカテーテル先端が留置されるため、血栓性合併症や感染性合併症などの重 篤な有害事象につながる危険性もある。これらの状況を受けて、東北大大学院医学系研究科移植再建内視鏡外科講. PDF 猫のビンブラスチン 2.0mg/m 投与後の有害事象について. 1.5mg/m2としており、現在までに3例の猫で投与したが、重 篤な有害事象は発生していない。今後は早期に第Ι相試験を 実施し、猫のビンブラスチンの安全な薬用量を決定する必要 性を強く感じた。 参 考 文 献 1) Bailey DB, Rassnick KM, Kristal O, et al (2008): J. Vet. Intern. Gcp改訂ポイントと治験使用薬周りの運用まとめ | 治験のチカラ. 新たな有害事象の定義(gcp第2条 ガイダンス) 「有害事象」とは、 治験使用薬 又は 製造販売後臨床試験使用薬 を投与された被験者に生じた全ての好ましくない又は意図しない疾病又はその徴候(臨床検査値の異常を含む。. PDF バイポーラコード. 出力端子に接続すると、予期せぬ出力電力が発生し、重 篤な有害事象を引き起こす可能性がある] (併用医療機器) 他社製品(指定製品以外)との併用(「相互作用」の項 参照) 【形状・構造及び原理等】 1. 組成. DOC IIS Windows Server. 研究者等(担当医)は、重篤な有害事象/不具合が発現した場合、適切な処置を行い、研究機関の研究責任者に報告する。 研究機関の研究責任者は、研究者等に以下を確認する。 . ①有害事象名/不具合名 ②重症度分類1) ③重篤性2) 、重篤と判断した理由 . 喪 が 明ける と は
PDF 人を対象とする生命科学・医学系研究における 安全性情報等の取扱いに関する標準業務手順書. 研究責任者は、侵襲を伴う介入を行う研究において、研究に関連する予期しない重 篤な有害事象および不具合等が発生した場合には、当該事象に関する対応の状況・結 果を公表するとともに、厚生労働大臣へ所定の方法により逐次報告するものとする。. 有害事象とは | 製薬業界 用語辞典 | Answers(アンサーズ). 有害事象は臨床試験の治験において、特に必要な報告である。この際、治験の責任医師が有害事象の内容を確認・判断し、記録する。 評価方法 評価方法は組織等によって異なるが、治験では主に重症度によって以下の5段階に分けられる。. PDF 治験薬概要書における安全性参照情報の記述に関す るガイドライン. 重篤有害象を 予測可能な重篤副作用としてrsiに入れることは認めな い。 () 致死的及び(または)生命を脅かす重篤な副作用 通常、治験依頼者は治験薬が致死的及び(または)生命を脅かす重 篤な副作用を起こすことを予測してはならない。. PDF 産業医科大学 安全性情報(重篤な有害事象等)に関する標準業務手順書. 重篤な有害事象のうち、研究計画書、インフォームド・コンセントの説明文書、添付文書等 . 研究責任者は、侵襲を伴う研究を実施しようとする場合には、あらかじめ、研究計画書に重 篤な有害事象等が発生した際に研究者等が実施すべき事項に関する . PDF 重篤な有害事象等発生時の報告・対応 に関する標準業務手順書. (1) 共同研究であって他施設が主幹となって実施されている研究において本学医学部で重 篤な有害事象等が生じた場合の対応手順は、上記2. 対応手順〔本学医学部が主幹であり 本学医学部において重篤な有害事象が生じた場合〕の(1)~(4)に準じる。. PDF 大阪国際がんセンター 人を対象とする生命科学・医学系研究における 重篤な有害事象等に関する標準業務手順書. 5 研究責任者は、研究に係る試料・情報の取得を研究協力機関に依頼した場合であって、研究対象者に重 篤な有害事象が発生した場合には、速やかな報告を受けるものとする。 (重篤な有害事象等の報告・当院発生分). PDF 弘前大学医学系部局における 人を対象とする生命科学・医学系研究 実施中の重篤な有害事象発生時の対応 に係る標準業務手順書. 4 研究計画書において,重篤な有害事象発生時の手順が別途定められている場 合には,本手順書の規定に関わらず,当該手順に従うものとする。 (重篤な有害事象) 第2 条 本手順書では,以下の事象を「重篤な有害事象」として取り扱うものと する。. 「重篤」の読み方は? 大人なら意味もきちんと知っておきたい | Oggi.jp. 「篤」という漢字には、「人情にあつい」「病気がおもい」のどちらの意味もありますが、「重篤」といった場合は、病気がおもいことを表します。 (ことばの総泉挙/デジタル大辞泉より) 【もっとことばの達人になりたいときは!. PDF 申請医療機関からの報告について 千葉大学医学部附属病院 [有害事象報告とそれに伴う対応]. る有害事象と判断され、客観的に安全性が確認されるまで先進医療は再 開しないという方針であることを確認した。平成29年6月23日付け、 最終報を受理。最終的な判断は因果関係不明の死に至る有害事象であっ たとのこと。. PDF CTCAE ではAE Adverse Events )について重症度のスケール Grade)を以下の 5 AE の 重症度の説明を個別に記載している. 骨髄抑制の重症度評価 Grade 1 Grade 2 Grade 3 Grade 4 Grade 5 白血球 減少 <施設基準下限 値~ 3000 /mm3 <3000~ 2000 /mm 3 <2000~ 1000.